Dr Véronique Mondain1, Dr Nicolas Retur2, Dr Benjamin Bertrand3, Dr Florence Lieutier-Colas4, Dr Philippe Carenco5, Dr Sylvain Diamantis6
1CHU de Nice, service des maladies infectieuses et tropicales, 2CHU de Nice, pharmacie, 3CH de Grasse, pharmacie, 4CHU de Nancy, AntibioEst, 5CH de Hyères, Hygiène, 6CH de Melun, Infectiologie.

A l’heure où la résistance bactérienne aux antibiotiques est devenue un des défis de l’humanité, comme l’a rappelé Ban Ki-moon, Secrétaire général des Nations-Unies, lors du discours d’inauguration de l’Assemblée générale de l’ONU en 2016, nous avons une connaissance de plus en plus précise des mécanismes qui en sont responsables. Au-delà du mésusage en médecine humaine, d’autres causes sont identifiées, qui posent un problème éthique et imposent de réfléchir sous l’objectif d’«Une Seule Santé».
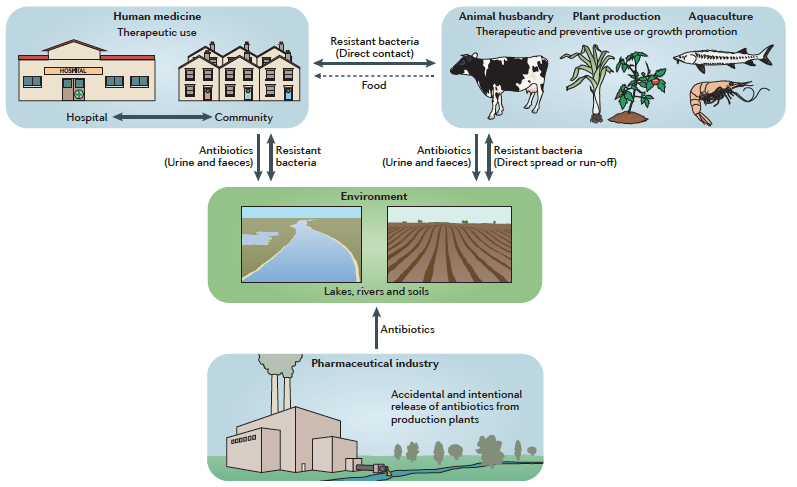
En effet, il est clairement identifié à l’heure actuelle que les deux anomalies (dysfonctionnements) principales concernant le domaine des antibiotiques sont leur utilisation dévoyée dans l’industrie agro-alimentaire, et leur mode de production, source de fabrication et de dissémination de la résistance bactérienne.
1. Antibiotiques chez l’animal
Depuis les années 1950, grâce à une autorisation initiale de la Food and Drug Administration, les antibiotiques sont utilisés comme facteurs de croissance dans les élevages. Aujourd’hui, 70% de la totalité des antibiotiques consommés dans le monde le sont par les animaux, essentiellement de rente1. Rappelons que la délivrance d’une dose modérée mais permanente d’antibiotiques dans la nourriture permet une prise de masse pondérale évaluée à environ 2%, en lien avec la modification du microbiote de l’animal et une assimilation accrue de l’apport calorique de sa nourriture. Les animaux éliminent ces antibiotiques dans les sols, via leurs excréments, participant à leur présence dans tous les milieux naturels. Ils hébergent également des bactéries multi résistantes (BMR), sélectionnées dans leur tube digestif par ces antibiotiques, et alors contaminent les humains via leur consommation. Actuellement, les données de l’E-CDC (European Center for Disease Control), qui surveille la présence de bactéries multi-résistantes de type entérobactéries C3G R dans les échantillons de viande européenne, prouvent qu’environ 50% de ces échantillons sont contaminés, avec des chiffres très variables en fonction des pays2. Les poissons ne sont pas en reste, même si les études sont moins nombreuses, que les échantillons proviennent de fermes d’élevage ou non (études sur les marchés chinois3, fermes coréennes4, lacs tanzaniens5).
Si l’Europe a pris des mesures pour interdire cette utilisation des antibiotiques comme facteur de croissance depuis 20066, et si en France, le plan Eco-Antibio a permis une réduction de 25% à 37% de l’utilisation des antibiotiques7, leur consommation reste malgré tout très élevée en raison des modes d’élevage concentrationnaires des animaux, responsables d’un potentiel de propagation des infections extrêmement rapide, nécessitant alors le traitement préventif de tout l’élevage si quelques bêtes sont malades (métaphylaxie). En dehors de l’Europe, la plupart des pays n’ont pas renoncé à l’utilisation des antibiotiques comme complément alimentaire (USA, Chine, Amérique du Sud, Afrique…) et prévoient même d’augmenter leur consommation dans l’élevage8,9. Les importations, favorisées par les accords commerciaux internationaux, sont alors sources de produits à risque.
2. Fabrication des antibiotiques
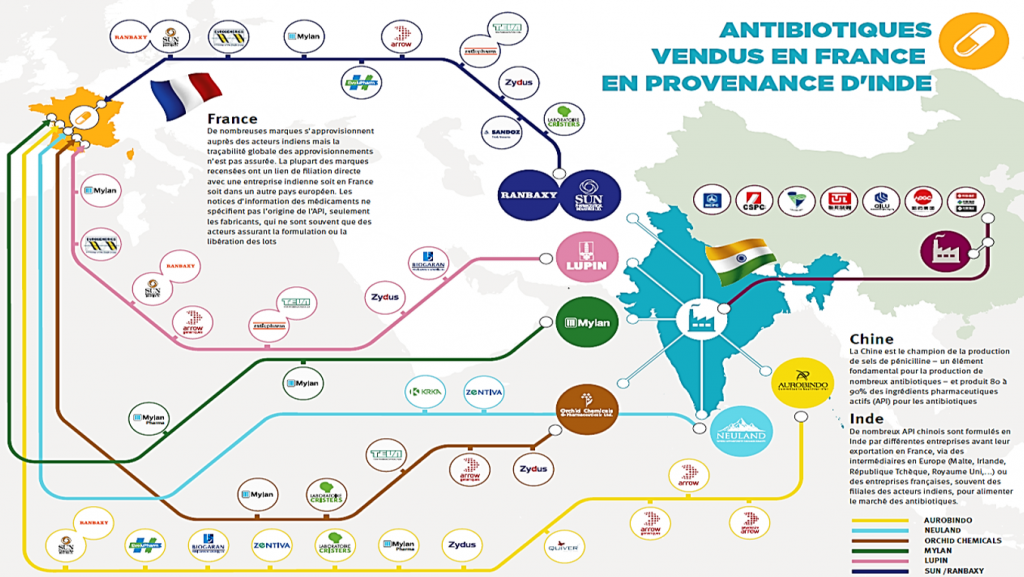
Depuis les années 1990, la plupart des grands groupes pharmaceutiques ont délocalisé leurs productions dans les pays émergents, essentiellement l’Inde et la Chine, en raison de conditions économiques très favorables: main-d’œuvre bon marché, réglementations très souples et absence de contraintes environnementales, qui commençaient à apparaître dans les pays développés. C’est Joachim Larsson, en 2007, qui a été lanceur d’alerte, en dosant dans les rivières indiennes, effluents de ces usines de production, des quantités de ciprofloxacine atteignant 31 milligrammes par litre10. Depuis, saluons le travail de l’ONG Changing Market11 qui a réalisé de nombreux rapports attestant des dégâts environnementaux et sanitaires majeurs de cette production. La pollution des lacs et des rivières, dans ces pays où les réseaux d’assainissement des eaux domestiques sont rudimentaires, conduit à la mise en contact de bactéries entériques en grande quantité et de molécules antibiotiques, ce qui provoque la sélection de bactéries multirésistantes. De nombreux travaux confirment actuellement des concentrations importantes de quinolones, sulfamides, antifongiques, dans les cours d’eau de la région d’Hyderabad, zone du centre de l’Inde spécialisée dans l’industrie pharmaceutique. Dans ces lacs et rivières, on trouve également de grandes quantités de BMR et de gènes de résistance, de type BLSE ou carbapénémases (NDM1, KPC…)12,13. Ces bactéries sont ensuite absorbées par la population locale qui paie un très lourd tribut à la résistance. La mortalité infantile, par diarrhée secondaire à des bactéries inaccessibles au traitement antibiotique, touche au moins 70 000 bébés par an14, 90% des habitants de ces régions sont porteurs de BMR dans leur flore digestive, et 40% des bactériémies sont dues à des bactéries BLSE. Le commerce international, les mouvements de population (tourisme, tourisme médical, l’Inde se positionnant actuellement comme le recours médical d’un grand nombre de pays en voie de développement), l’augmentation massive des transports aériens, aboutissent alors à la diffusion planétaire de la résistance. A cette diffusion d’origine anthropique, il faut ajouter le brassage lié aux échanges naturels liés aux migrations animales, aux courants océaniques, aux flux hydrologiques continentaux, qui aboutissent à la constitution d’un réservoir de gènes d’antibiorésistance encore peu exploré dans une approche «One Health», et qui gagne les écosystèmes les plus isolés de la planète comme les milieux polaires15,16,17.
Nous, pays occidentaux qui avons délocalisé notre production de médicaments pour des raisons de coûts, sommes alors confrontés aux conséquences de ces choix, qui posent des problèmes éthiques et sanitaires, ainsi qu’une question stratégique de sécurité d’approvisionnement et d’autonomie industrielle, nécessitant une réflexion et une réaction urgentes.
La Chine semble avoir pris des décisions positives dans le domaine de la pollution environnementale sans que des éléments précis soient connus concernant la pollution des effluents (Plan Blue Sky). En revanche, l’Inde projette un nouveau développement de l’industrie pharmaceutique «Pharma City» qui annonce des facilitations environnementales, mais qui devront être auditées. Les leviers sont alors entre les mains des pays acheteurs, pour exiger ces contrôles mais aussi soutenir financièrement ces pays, et leur permettre d’évoluer vers des pratiques plus vertueuses en maintenant pour eux la possibilité de réaliser une production non délétère pour leur population et environnement.
A. Le problème de l’opacité de la chaîne de fabrication des antibiotiques
Si vous demandez au directeur médical du laboratoire qui vient vous présenter une nouvelle molécule où celle-ci est fabriquée précisément, il est peu probable qu’il vous réponde. Un groupe de travail de médecins et pharmaciens français s’est intéressé à ce sujet, et a interrogé dix des plus grands laboratoires, dont des génériqueurs. Six n’ont pas souhaité répondre, et quatre ont invoqué le secret industriel18. Tous ont été étonnés de cette question, disant qu’elle leur était posée pour la première fois. Actuellement, seule l’ANSM, au moment de l’enregistrement d’un nouvel antibiotique, dispose de cette information qui n’est pas renseignée pour les antibiotiques produits sur le marché avant 2006. La figure ci-jointe, issue d’un rapport de l’ONG Changing Market19, illustre l’opacité et la complexité des chaînes de distribution des antibiotiques.
B. L’absence de critères environnementaux imposés par les acheteurs
Après plusieurs scandales incriminant notamment les manufactures et usines chinoises, les laboratoires sous-traitants sont contraints de travailler selon les «Bonnes pratiques de fabrication» ou GMP (Good Manufacturing Practices), qui garantissent la qualité des produits exportés vers les marchés européens et américains. Cependant, aucun critère environnemental concernant le risque de résistance n’est demandé à l’industrie. Si des normes sont imposées pour le rejet de certains métaux ou toxiques, aucun dosage d’antibiotique dans les effluents, aucune recherche de résistance bactérienne n’est exigée. Ce manque juridique et réglementaire majeur explique que les sous-traitants ne mettent pas en œuvre des techniques pourtant connues d’amélioration de l’impact environnemental de la production, comme le traitement interne des eaux usées selon le procédé zero liquid discharge (ZLD)20, théoriquement installé dans les usines de production, mais sans vérification ni sanction en Inde21. Les déversements illégaux de rejets industriels sont également habituels22.
Bien que la plupart des études montrent (expérimentalement ou théoriquement) un lien causal entre les rejets dans les effluents et la diffusion de l’antibiorésistance23, l’Agence Européenne des Médicaments (EMA) n’a toujours pas légiféré, l’actualisation en 2018 n’intégrant pas de valeurs seuils d’antibiotiques dans les prélèvements des effluents sur la dernière actualisation de l’Environnemental Risk Assessment figurant dans les dossiers de demande d’AMM. Pourtant, de nombreuses publications permettent d’utiliser des référentiels dans ce domaine, notamment la PNEC-MIC, (Predict No Effect Concentration), la concentration d’antibiotiques rapportée à la CMI, et qui ne produirait pas d’effet sur l’apparition de gènes de résistance24.
Les centrales d’achat, qui achètent les antibiotiques pour nos hôpitaux, choisissent les fournisseurs en fonction de critères de qualité, d’indication et de prix. A ce jour, les autres critères, dont les critères de fabrication «écologiques», n’interviennent pas dans la discussion. L’introduction systématique d’un pourcentage fixé de ces critères pourrait influencer les marchés. En ville également, une information claire sur une «note» écologique pourrait faire pencher la balance vers tel ou tel générique.
C. La souveraineté française ou européenne
La syndémie COVID a été l’occasion de constater l’absence générale d’autonomie de notre pays à protéger et soigner les Français: absence de matériel de protection, difficultés à réaliser et organiser des tests diagnostiques performants, incapacité à produire des vaccins, soumission aux pénuries d’antibiotiques dues à la situation de confinement en Chine. Notre pays ne s’est plus donné les moyens de répondre aux enjeux de souveraineté nationale en matière de santé publique. Cette prise de conscience est peut-être une chance, celle de reconsidérer la nécessité absolue de maîtriser l’ensemble de la chaîne du soin, depuis les molécules, les dispositifs médicaux, les outils diagnostiques, jusqu’aux données numériques, aux moyens logistiques biologiques et virologiques.
Même si cette réflexion est nécessaire et doit absolument aboutir à transformer notre dépendance totale en besoins partiels, cette évolution prendra du temps, et en attendant, il est impératif que notre pays, dans un travail collaboratif avec l’Europe, voire les acteurs internationaux, obtienne des producteurs d’antibiotiques un changement majeur dans leur mode opératoire.
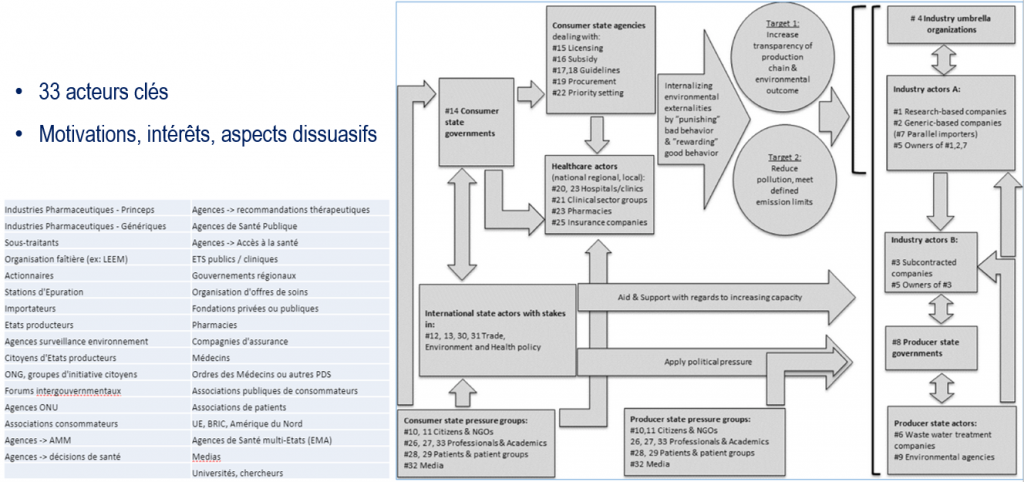
Aujourd’hui, de nombreux scientifiques, industriels, politiques, reconnaissent cette pollution comme un risque inutile et inacceptable. Cependant, toute tentative d’évaluation ou de réduction se heurte rapidement à une réalité complexe qui nécessite de comprendre les incitations et contre-incitations dans une approche systémique, décrite récemment par Nijsingh et Larsson dans cet article25.
Au forum de Davos en 2017, de nombreux industriels se sont engagés à créer une feuille de route commune concernant notamment les critères environnementaux, et il faut saluer cette initiative (AMR Industry Alliance26). Mais en 2020, certains ont quitté ce groupe devant le coût qui s’y rapporte.
Il faut alors augmenter la pression politique tant nationale qu’internationale, informer via les médias, rassembler les scientifiques, informer les usagers, en faisant prendre conscience des risques liés à cette résistance, dans un contexte de diminution de possibilité de créer de nouveaux ATB.
Plusieurs propositions européennes viennent de voir le jour fin 2021 dont on espère avant tout, qu’au-delà du soutien à l’industrie et à la production de nouveaux antibiotiques, elles insisteront sur les principes de sobriété dans l’utilisation des antibiotiques, de promotion de l’utilisation des antibiotiques à spectre étroit, de mise en place de mesures environnementales strictes27,28,29, 30.
En France, l’introduction de critères environnementaux dans le choix des antibiotiques dans la feuille de route de l’antibiorésistance est en cours de discussion.
En conclusion, nous avons tous un rôle à jouer
L’information a un rôle central: transparence, coopération, contrôles, d’autant que d’autres acteurs apparaissent sur la scène de la production des antibiotiques, en Amérique du Sud et en Afrique, où les problèmes se reproduisent et menacent également grandement les populations locales.
Par une action coordonnée au niveau européen et mondial, nous devons fortement limiter l’utilisation des antibiotiques dans les élevages, et améliorer les conditions de production des antibiotiques par les sous-traitants. Les pays consommateurs à revenu élevé, les institutions publiques, les industriels, sont dans une position clé pour initier un changement efficace via des incitations réglementaires, économiques et politiques. La dimension éthique de cette problématique complexe mérite d’être discutée en priorité.
1 The challenge of antimicrobial resistance: What economics can contribute Laurence S. J. Roope , science 2019, vol 364 N6435
2 www.efsa.europa.eu/efsajournal EFSA Journal 2021;19(4):6490
3 https://pubmed.ncbi.nlm.nih.gov/30414589/
4 https://pubmed.ncbi.nlm.nih.gov/29031406
5 https://pubmed.ncbi.nlm.nih.gov/27990135/
8 https://pubmed.ncbi.nlm.nih.gov/34375247/
9 https://pubmed.ncbi.nlm.nih.gov/31401170/
11 https://changingmarkets.org/
12 Larsson 2014 pollution from drug manufactoring.pdf
13 Lübbert2017_Article_EnvironmentalPollutionWithAnti.pdf
14 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6974503
15 Antibiorésistance et environnement, ANSES 2019
16 Sjölund M, Bonnedahl J, Hernandez J, Bengtsson S, Cederbrant G, Pinhassi J, Kahlmeter G, Olsen B. Dissemination of multidrug-resistant bacteria into the Arctic. Emerg Infect Dis. 2008 Jan;14(1):70-2
17 Blanco-Picazo P, Roscales G, Toribio-Avedillo D, Gómez-Gómez C, Avila C, Ballesté E, Muniesa M, Rodríguez-Rubio L. Antibiotic Resistance Genes in Phage Particles from Antarctic and Mediterranean Seawater Ecosystems. Microorganisms. 2020 Aug 24;8(9):1293
18 Mondain V, et al. Et si transparence et écotoxicité devenaient des nouveaux critères de prescription et d’achats des antibiotiques ? JNI 9 au 11 septembre 2020, Poitiers
19 https://changingmarkets.org/portfolio/bad-medicine
20 https://www.lenntech.fr/processes/Brine-Treatment/zero-liquid-discharge-zld.htm
23 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4251439/
24 https://setac.onlinelibrary.wiley.com/doi/full/10.1002/ieam.4141
25 Environ Health 2019 Nov 6;18(1):95. doi: 10.1186/s12940-019-0531-1
26 https://www.amrindustryalliance.org/
27 https://ec.europa.eu/health/human-use/strategy_fr
30 https://www.gov.uk/government/publications/g7-carbis-bay-health-declaration
Remerciements:
- Springer Nature (Figure 1)
- Changing Markets Foundation (Figure 2 et Photo)
- D.G.J. Larsson (Figure 3)
Vignette illustrative: Annie Cavanagh via Wellcome Collection